Neue Aspekte in Prävention und Früherkennung der Osteoporose
erschienen in: Frauenarzt 9, 1998
- 1 Einführung
- 2 Epidemiologische Betrachtungen
- 3 Was ist Osteoporose?
- 4 Trabekulärer/kortikaler Knochen
- 5 Knöcherner Umbau – Remodeling
- 6 Peak-bone-mass
- 7 High-/Low-turnover Osteoporose – Fast-Loser/Slow-Loser
- 8 Diagnose der Osteoporose
- 9 Labordiagnostik
- 10 Osteodensitometrie
- 11 Knochendichte und Struktur – die hochauflösende pQCT
- 12 Ultraschallmessungen
- 13 Reproduzierbarkeit/Genauigkeit
- 14 Wertung der Osteodensitometrie
- 15 Aktueller Stand der Prophylaxe- und Therapiemöglichkeiten
- 16 Antiresorptive Medikamente
- 17 Knochenaufbaustimulierende Medikamente
- 18 „Maßgeschneiderte“ Therapie
- 19 Mineralwasser als Calciumquelle
- 20 Fazit: Früherkennung!
- 21 Ein neues Screening-Modell
- 22 Osteoporose-Screening für alle?
- 23 Mikrokallusbildungen! Bedeutung bisher verkannt?
- 24 Erst die Strukturdarstellung gibt Aufschluß!
- 25 Kostensenkung durch Screening?
- 26 *ZMORG – Zürich-München-Osteoporosis-Research-Group
Einführung
Auch die Pharmaindustrie hat diese Entwicklung erkannt. So vergeht kaum ein Monat, in dem nicht wenigstens eine Fortbildungsveranstaltung zum Thema Osteoporose stattfindet und die Entwicklung neuer Osteoporosemedikamente hat Hochkonjunktur. Parallel dazu schießen neue Diagnosemethoden und Osteoporosespezialisten wie Pilze aus dem Boden. Die Folge: Unsicherheit bei den in der Praxis mit dieser Krankheit konfrontierten Ärzten.
Schließlich gibt es aber in Diagnose wie Therapie vielversprechende Neuentwicklungen, die zu einer besseren „Beherrschung“ der Krankheit beitragen könnten. Ein wesentlicher Punkt ist dabei – die Krankheit Osteoporose ist immer noch nicht heilbar im Sinne einer restitutio ad integrum – die Früherkennung und Prävention.
Epidemiologische Betrachtungen
Allerdings ist nicht ganz klar, wie diese Zahlen gewonnen werden. Nicht jede diagnostizierte Osteoporose scheint tatsächlich eine solche zu sein, wie wir in unserer täglichen Praxis feststellen müssen. In Anbetracht zahlreicher verschiedener Meßverfahren (Osteodensitometrien, Ultraschallmessungen, biochemische Knochenmarker, Gentests) scheint es mitunter nicht ganz unabhängig vom Zufall zu sein, zu welchem Untersucher das Schicksal einen treibt, ob man mit dem Etikett Osteoporose versehen wird oder nicht.
Was ist Osteoporose?
„Osteoporose ist eine systemische Skeletterkrankung, bei der es aufgrund eines erhöhten Verlustes von Knochenmasse zu einer reduzierten Knochenmasse und damit zu einer Beeinträchtigung der knöchernen Strukturen kommt, was schließlich zu einer erhöhten Brüchigkeit des Knochens führt. Die Höhe der Ausgangsknochenmasse sowie Ausmaß und Dauer des knöchernen Masseverlustes bestimmen die Wahrscheinlichkeit (Risiko) des Auftretens einer Osteoporose!“
Es sind also drei Faktoren, die schließlich zur manifesten Osteoporose führen:
1. reduzierte Knochenmasse – Statik
2. Verlust von Knochenmasse – Dynamik
3. Strukturdefekte – Funktion
Aufgrund des Masseverlustes (erhöhte Dynamik) kommt es zu einer Verminderung der (noch) vorhandenen Knochenmasse (verschlechterte Statik) und zu einer Störung der knöchernen Strukturen (Funktionsverlust). Der Funktionsverlust in Form einer gestörten knöchernen Mikroarchitektur, der letztlich zu einer mangelnden Knochenqualität und damit zu einer mangelnden Stabilität führt und für die gehäuften Frakturen verantwortlich ist, scheint dabei der zentrale und bis heute viel zu wenig beachtete Aspekt der Osteoporose zu sein.
Insofern muß die aktuelle WHO-Definition der Osteoporose auf Basis der Osteodensitometrie für fragwürdig gehalten werden. Diese definiert die Osteoporose ab einer Knochendichte unterhalb 2 ½ Standardabweichungen des Durchschnittswertes junger gesunder Erwachsener – peak-bone-mass (Osteopenie unterhalb 1 bis 2 ½ StAbw.). Diese Definition bezieht sich aber nur auf die Knochendichte (Quantität), ohne den strukturellen Zustand des Knochens (Qualität) in Betracht zu ziehen. Sie greift also willkürlich einen der drei entscheidenden Faktoren heraus und ignoriert die anderen beiden. Sie ist damit unvollständig. So kann man zwei Patienten mit nahezu gleicher Knochendichte, z.B. 2 ½ Standardabweichungen unter dem Referenzwert, von denen der eine bedingt durch eine (genetisch und/oder entwicklungsbedingt) vermindert angelegte peak-bone-mass noch über eine völlig homogene und regelrechte Knochenstruktur verfügt, der andere aber bei ursprünglich viel höher ausgeprägter peak-bone-mass schon 25% oder mehr seiner Knochenmasse auf Kosten einer deutlich gestörten Mikroarchitektur verloren hat, nicht in die gleiche Schublade packen. Das Frakturrisiko ist bei dem zweiten Patienten sicher um ein vielfaches größer.
Sie unterscheidet aber auch nicht zwischen manifester Krankheit und Krankheits- bzw. Frakturrisiko. Schließlich ist die Entwicklung dieses Funktionsverlustes ein langandauernder Prozess und es ist die Geschwindigkeit, mit der dieser Prozess(Mineralverlust) verläuft, die entscheidet, ob und wie schnell es schließlich zu – ja was kommt? Eigentlich zu einer Manifestation der Osteoporose, also zur osteoporotischen Fraktur. Auch dies ist ein generelles Manko im heutigen Gebrauch des Begriffes Osteoporose, daß zu viel darunter subsumiert wird: die (manifeste) Krankheit, der Prozess (Mineralverlust), eine verminderte Knochendichte, das Frakturrisiko. Indem jeder etwas anderes mit dem Begriff Osteoporose meint, kommt es zu einer Begriffsverwirrung derart, daß zwar zahlreiche Patienten mit dem Etikett Osteoporose versehen werden, wobei die einen aber nur ein erhöhtes Risiko aufweisen, während andere schon an der manifesten Krankheit mit teilweise schwersten osteoporotischen Frakturen leiden.
Trabekulärer/kortikaler Knochen
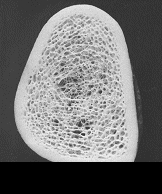
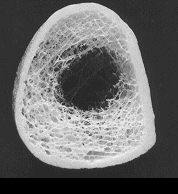
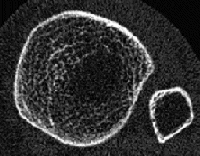
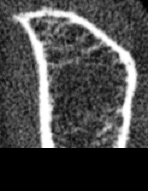
Dabei betrifft der „Prozess“ Osteoporose, der Mineralverlust, lange Zeit praktisch ausschließlich den trabekulären Knochen und erst sehr viel später den kortikalen Knochen. Grund ist der ca. 10-fach intensivere Stoffwechsel des trabekulären im Vergleich zum kortikalen Knochen. Besteht der kortikale Knochen aus kompakt angeordneten Lamellen, bildet der trabekuläre Knochen ein hochkomplexes dreidimensionales und verzweigtes Netzwerk aus Knochenplättchen und -bälkchen – den Trabekeln. Beide Knochenarten kommen in wechselnder Zusammensetzung im gesamten Skelett vor, zu dessen Gesamtmasse der kortikale Knochen ca. 80% beiträgt, der trabekuläre Knochen hingegen nur rund 20%. Andererseits nehmen aber diese 20% trabekulärer Knochen immerhin 80% der gesamten Oberfläche des Skelettes ein und letztlich ist es diese viel größere Angriffsfläche, die den trabekulären Knochen weit „verwundbarer“ und für einen Abbau empfindlicher macht. Abb. 1 und 2 zeigen diesen unterschiedlichen Aufbau:
Die Trabekel weisen im gesunden Knochenpräparat (links) ein dichtes und homogenes „Netzwerk“ auf, das vom kortikalen Knochen wie ein „Panzer“ umhüllt wird. Im Gegensatz hierzu sind die Trabekel beim osteoporotischen Knochen (rechts) schon erheblich reduziert, wodurch die „Hohlräume“ zwischen den einzelnen Trabekeln deutlich an Größe zunehmen. Zentral sind die Trabekel praktisch schon völlig aufgelöst. Es ist einleuchtend, daß dieser Knochen nicht mehr sehr stabil ist. Der kortikale Knochen weist dagegen auch beim osteoporotischen Knochen noch kaum Strukturdefekte auf und erscheint im Vergleich zum gesunden Knochen lediglich gering verschmälert.
Knöcherner Umbau – Remodeling
Knochen ist kein starres Organ. Zeitlebens kommt es zu einem ständigen An- und Abbau von Knochensubstanz, wobei die durch körperliche Aktivität auftretenden und über die Muskulatur vermittelten axialen Druck- und Zugkräfte auf den Knochen den wesentlichen Anreiz für diesen Umbau darstellen. Rund 10% der Skelettmasse werden im Prozess dieses Remodeling jährlich erneuert. Verantwortlich für diesen lebenslang ablaufenden Umbau sind zwei gegensinnig arbeitende, aber dennoch in ihrer Arbeitsweise eng gekoppelte Zellsysteme – die Osteoblasten und die Osteoklasten. Während die Osteoklasten sog. Resorptionslakunen in den Knochen „fressen“, werden diese Lakunen anschließend von den Osteoblasten wieder mit neuer Knochensubstanz aufgefüllt. Nur die strenge Einhaltung dieser Reihenfolge (Coupling) sichert einen den jeweiligen Belastungen ideal angepaßten knöchernen Umbau. Bei der Osteoporose kommt es in irgendeiner Form immer zu einer Entkopplung dieses Prozesses.
Peak-bone-mass
Um das 30. bis 35. Lebensjahr wird die für jeden spezifische Spitzenknochenmasse – die peak-bone-mass – erreicht. Die Ausprägung dieser peak-bone-mass ist neben genetischen Faktoren von Ernährung (vor allem im Kindes- und Jugendalter), körperlicher Aktivität, Sonneneinwirkung (Vitamin-D-Bildung) und anderen Faktoren abhängig. Nach einer individuell verschiedenen Zeitspanne, in der sich An- und Abbau in etwa die Waage halten, kommt es dann vor allem bei Frauen ab dem 5. Lebensjahrzehnt allmählich zu einem Überwiegen des Knochenabbaues. Solange der Nettoverlust an Knochenmasse dabei 1% der vorhandenen Knochenmasse jährlich nicht überschreitet, sollte es auch nicht zur Ausbildung einer Osteoporose kommen, eine ausreichende peak-bone-mass vorausgesetzt.
High-/Low-turnover Osteoporose – Fast-Loser/Slow-Loser
In letzter Konsequenz ist es immer die Entkopplung der Aktivität der Osteoklasten und der Osteoblasten, die zu einer Osteoporose führt. Ist nur der knöcherne Anbau bei normaler Abbaurate gestört, sprechen wir von einer Low-turnover-Osteoporose (geringer Umsatz an Knochenmasse). Ist der Abbau erhöht, liegt eine High-turnover-Osteoporose (hoher Massenumsatz) vor. Bis vor kurzem ging man davon aus, daß postmenopausal zunächst ein „high-turnover“ (Typ-I-Osteoporose) vorherrschen sollte, während im Alter (Typ-II-Osteoporose) ein „low-turnover“ vermutet wurde. Neue Studien – auch unsere eigenen Arbeiten – zeigen aber, daß gerade im fortgeschritteneren Alter, vor allem bei schon verminderter Knochenmasse, ein „high-turnover“ zu überwiegen scheint. Je höher aber dieser Verlust an Knochenmasse, um so eher wird die kritische Schwelle an Knochenmasse unterschritten, ab der das Risiko osteoporotischer Frakturen zunimmt. Dieser Verlust kann durchaus einige Prozent der vorhandenen Knochenmasse ausmachen. Da er zunächst nur den trabekulären Knochen betrifft, bezeichnen wir einen Verlust von über 3% trabekulärer Knochenmasse jährlich als Fast-Loser-Situation. Entsprechend weisen Slow-Loser einen trabekulären Masseverlust unter 3% pro Jahr auf. Ca. 30-40% aller Frauen machen postmenopausal – oft über Jahre – solche Phasen eines beschleunigten Masseverlustes über 3% jährlich durch; diese gilt es vor allem zu selektieren, um sie frühzeitig einer antiresorptiven Therapie bzw. Prophylaxe zu unterziehen.
Diagnose der Osteoporose
Eine gründliche Anamnese und die Abklärung von Risikofaktoren stellen den ersten Schritt dazu dar. Genetische Vorbelastung und persönliche „Knochengeschichte“ (wichtig für die Ausprägung der peak-bone-mass), müssen ebenso erfragt werden wie häufige Zyklusanomalien, verspätet einsetzende Menarche bzw. verfrüht einsetzende Menopause oder operative Entfernung der Eierstöcke. Auf Ernährungsgewohnheiten (Calciumbilanz) ist genauso zu achten wie auf Krankheiten oder Medikamente (z.B. Kortison!), die eine sekundäre Osteoporose möglich machen. Körperliche Zeichen wie Größenverlust, verstärkte Kyphose, Hartspan der Muskulatur oder Hautzeichen wie das Tannenbaumphänomen sind in der Regel erst bei fortgeschritteneren Krankheitsstadien zu sehen. Die Radiologische Diagnostik dient vor allem zur Abklärung des Frakturstatus (vor allem Wirbelsäulenaufnahmen). Knochenbiopsien werden heute eher selten bei ätiologisch unklaren Osteoporosen bzw. zum differentialdiagnostischen Ausschluß einer Osteomalazie durchgeführt. Neue Entwicklungen sind im Bereich der biochemischen Knochenmarker und bei der Osteodensitometrie zu verzeichnen, weshalb auf diese beiden Punkte genauer eingegangen werden soll.
Labordiagnostik
Neben den Basisparametern wie Calcium, anorg. Phosphat und knochenspezifische Alkalische Phosphatase stehen heute einige neue Marker zur Beurteilung des Knochenstoffwechsels zur Verfügung.
- Desoxypyridinolin und Pyridinolin sind wie das Hydroxyprolin Marker für einen erhöhten Knochenverlust, jedoch weisen die Messungen dieser sog. „Crosslinks“ geringere Fehlerquellen auf, so daß sie heute der Hydroxyprolinmessung vorzuziehen sind. Wegen der großen Überlappung der Normbereiche Gesunder und Osteoporotiker, sind diese vor allem für Therapie- bzw. Verlaufskontrollen sinnvoll.
- Osteocalcin könnte als nichtkollagenes Protein im Knochen, das vor allem von den Osteoblasten synthetisiert wird, in Zukunft eine größere Bedeutung als biochemischer Marker für die Formation von Knochen bekommen. Histologische Studien haben eine signifikante Korrelation zwischen Knochenbildung und Serumkonzentration des Osteocalcins gezeigt, allerdings ist die routinemäßige Bestimmung für die Praxis wegen der mangelnden Stabilität (Blut muß sofort zentrifugiert und das Serum eingefroren versandt werden) noch problematisch.
Im allgemeinen reicht ein Marker für die Formation von Knochen (AP) sowie ein Abbaumarker (Desoxypyridinolin) neben den Basismarkern aus. Zu beachten ist, daß aufgrund der biochemischen Marker keine Diagnose der Osteoporose zu stellen ist, da diese nur eine „Momentaufnahme“ des Knochenstoffwechsels zeigen und vor allem Informationen zum Verlauf unter Therapie bzw. zur Unterscheidung High- oder Low-turnover-Osteoporose geben. Weitere Parameter wie Parathormon, 25-OH-Vitamin D3 bzw. 1,25-(OH)2-Vitamin D3 sind meist nur bei speziellen Fragestellungen notwendig, ebenso wie z.B. der Nachweis von Bence-Jones-Proteinen, Cortisol etc. bei V.a. eine sekundäre Osteoporose.
Osteodensitometrie
Die Osteodensitometrie stellt nach wie vor das wichtigste Verfahren bei der Diagnose der Osteoporose dar. Es soll daher ein kurzer Abriß des aktuellen Standes der Osteodensitometrie versucht werden. Bei der Definition der Osteoporose haben wir drei wesentliche Punkte unterschieden:
1. reduzierte Knochenmasse – Statik
2. Verlust von Knochenmasse – Dynamik
3. Strukturdefekte – Funktion
Dazu kommt 4. die so wichtige Differenzierung zwischen trabekulärer und kortikalerKnochenmasse und 5. die zuverlässige Unterscheidung zwischen Fast– und Slow-Losern. Je schneller das Ausmaß des Masseverlustes beurteilt werden kann, um so eher kann dieser auch gestoppt werden. Die Reproduzierbarkeit der verwendeten Methode stellt hier die entscheidende Größe dar. Eine rationale Diagnostik sollte diese Forderungen möglichst alle erfüllen und dabei 6. nur eine geringe Strahlenbelastungaufweisen.
- Absorptiometrische Verfahren zählen nicht nur zu den historisch ersten Knochendichtemeßverfahren, sondern stellen nach wie vor die am weitest verbreiteten Verfahren dar. Die zuerst verwendete SPA (Single-Photonen-Absorptiometrie) ist heute nahezu vollständig von der DPA (Dual-Photonen-Absorptiometrie) bzw. der DXA (Dual-Xray-Absorptiometrie) ersetzt worden. Gemessen wird die Absorption von Photonen, wobei über den Anteil absorbierter Strahlung auf die „Knochendichte“ geschlossen wird. Meßorte sind Wirbelsäule, Radius und Schenkelhals, wobei auch Ganzkörpermessungen möglich sind. Gemessen wird allerdings nur eine physikalisch unklar definierte „Flächendichte“ in g/cm2 und keine echten Dichtewerte. Eine Strukturbeurteilung des Knochens ist nicht möglich und bei Reproduzierbarkeiten von durchschnittlich 1,5-2% ist z.B. ein Knochenmasseverlust von 3% pro Jahr – immerhin eine Fast-Loser-Situation – frühestens nach 1 1/2 bis 2 Jahren möglich. Außerdem kann nicht zwischen trabekulärem und kortikalem Knochen unterschieden werden; man erhält nur „Mischwerte“ aus beiden Knochenarten. Zur Diagnose der Typ-I-Osteoporose ist aber ein trabekelspezifischer Osteoporosetest zu fordern! Die Strahlenbelastung ist mit 0,1-1mrem sehr gering.
- Mit der quantitativen Computertomographie – QCT – an der Wirbelsäule wurde aufgrund der Rotation des Röntgenstrahls um 360 Grad erstmals eine Volumenmessung mit echten Dichtewerte in mg/cm3 möglich. Zudem können damit auch trabekuläre und kortikale Knochendichten separat gemessen werden. Eine Beurteilung der knöchernen Strukturen ist jedoch auch hiermit nicht möglich. Außerdem stellt gerade die Wirbelsäule bei den doch meist älteren Osteoporosepatienten aufgrund häufiger skoliotischer und/oder degenerativer Veränderungen häufig keinen geeigneten Meßort mehr dar, können diese doch zu beträchtlichen Meßwertverfälschungen führen. Die Reproduzierbarkeiten sind nicht zuletzt wegen dieser Veränderungen zum Teil schlecht (bis zu 5%), so daß die zuverlässige Erfassung des genauen Masseverlustes nur bedingt möglich ist. Die Strahlenbelastung ist mit 40-100mrem die mit Abstand höchste aller Osteodensitometrieverfahren.
Knochendichte und Struktur – die hochauflösende pQCT
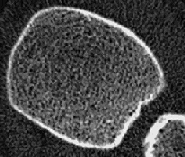
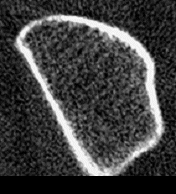
- Die hochauflösende periphere, quantitative Computertomographie – pQCT– in der von uns verwendeten Schweizer Methode mit dem Densiscan 1000 stellt das neueste und derzeit weltweit einzige Verfahren dar, das alle vorher genannten 6 Forderungen erfüllt. Es ist insbesondere das bisher einzige Verfahren, welches eine Darstellung der knöchernen Mikroarchitektur ermöglicht und mit seiner hohen Auflösung von 0,2mm selbst die Trabekel sichtbar werden läßt (Abb. 3 und 4). Da es sich um eine volumetrische Messung handelt, werden auch hier, wie bei der quantitativen CT an der Wirbelsäule, echte Dichtewerte in mg/cm3 erhalten, und zwar ebenfalls getrennt für trabekulären und kortikalen Knochen. Schließlich können aufgrund der sehr guten Reproduzierbarkeit (0,2%-0,3% in praxi an gemischten Kollektiven!) Fast-Loser bereits nach 4-6 Monaten zuverlässig erkannt und so schnellstmöglich einer Therapie zugeführt werden. Die Strahlenbelastung ist mit 0,1mrem mit die geringste aller Osteodensitometriemethoden.
Abb. 3 zeigt unauffällige, homogen und harmonisch angeordnete trabekuläre Strukturen. Die Kortikalis umgibt als „heller Randsaum“ von deutlich höherer Dichte den trabekulären Knochen. Auf der Abb. 4 eines osteoporotischen Knochens ist ein bereits fortgeschrittenen Abbau der Trabekel, vor allem zentral und subkortikal, erkennbar, während die Kortikalis im Vergleich zum gesunden Knochen der Abb. 3 noch keine sichtbaren Veränderungen aufweist. Vergleiche dazu auch die Abbildungen 1 und 2.
Vor allem die neue Möglichkeit der Strukturbeurteilung bereichert die Diagnose um eine völlig neue, zusätzliche Dimension, die uns nicht nur eine erheblich höhere Sicherheit in der Interpretation der gemessenen Dichtewerte bietet, sondern uns praktisch auch die bisher verborgene „Rückseite der Medaille“ aufzeigt, ganz im Sinne der aktuellen Konsens-Definition (s.o.) der Osteoporose als Skeletterkrankung mit verminderter Knochenmasse und Störungen der knöchernen Mikroarchitektur. Die Abbildungen 3 und 4 zeigen Beispiele von Tomogrammen zur Beurteilung der knöchernen (hier vor allem der trabekulären) Strukturen, erhalten mit dem Densiscan 1000.
Ultraschallmessungen
- Ultraschallverfahren zur Knochendichtemessung werden in den letzten Jahren zunehmend angeboten. Vorteile: sie sind billig, wenig „zeitraubend“ und weisen keine Strahlenbelastung auf. Aber Ultraschallverfahren messen keine Knochendichte! Gemessen werden an Tibia, Fersenbein oder Finger verschiedene Eigenschaften wie die „Steifigkeit“ (stiffness – diese soll Aussagen über die strukturelle Beschaffenheit des Knochens machen), die Laufgeschwindigkeit oder die Schallabschwächung (attenuation). Doch auch diese Verfahren lassen keinen Blick in den Knochen zu und die Beurteilung des Knochens erfolgt über Form und Amplitudenhöhe der erhaltenen Kurven, woraus dann ebenfalls nur ein Frakturrisiko abgeleitet werden kann. Die Studienergebnisse an Kollektiven sind zwar ermutigend, doch für einen Ersatz am Individuum ist es sicher noch zu früh.
Reproduzierbarkeit/Genauigkeit
Bevor eine abschließende Wertung der derzeit verfügbaren Osteodensitometriemethoden versucht werden soll, muß noch näher auf zwei Begriffe eingegangen werden, die für die Meßgenauigkeit von großer Wichtigkeit sind.
Die Genauigkeit gibt letztlich an, wie nahe eine Messung den tatsächlichen Gegebenheiten auch wirklich kommt. Wenn echte Dichtewerte in mg/cm3 gemessen werden, ist das banal, man bräuchte nur die osteodensitometrisch erhaltenen Werte in Beziehung zu den Dichtewerten aus bioptisch erhaltenem Knochenmaterial zu setzen, um diese Frage zu beantworten. Werden nur „Flächendichten“ oder z.B. eine Steifigkeit gemessen, wird das Problem schon komplizierter, da ja die Genauigkeit des Meßwertes dann nicht mehr in Bezug zur tatsächlich vorhandenen Dichte, sondern nur zum Frakturrisiko gesetzt werden kann. Und diese Frage ist nur noch statistisch zu beantworten, wenn man nicht 20 Jahre warten will, um das einmal festgestellte Frakturrisiko an Hand der de facto aufgetretenen Frakturen am Individuum retrospektive auf seine Richtigkeit zu überprüfen.
Für die Beurteilung des Therapieerfolges sind aber Änderungen der Knochenmasse entscheidend, d.h. ob ein Verlust auftritt, wie hoch dieser ist und ob er unter Therapie verhindert wird. Die Reproduzierbarkeit, eine physikalische Größe, die von der jeweiligen Meßmethode abhängig ist, ist ein Maß für die Zuverlässigkeit der Messung. Wichtig für die Reproduzierbarkeit ist die sog. minimale relative Differenz – in unserem Fall an Knochenmasse -, die mit einer Methode gerade noch erfaßbar ist. Diese berechnet sich nach folgender Formel:
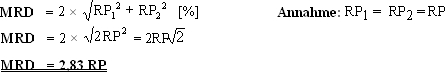
Mit RP1 bzw. RP2 werden die Reproduzierbarkeiten bei der Erst- und Zweitmessung bezeichnet, die von Methode und vom jeweiligen Gerät abhängig sind und bei beiden Messungen gleich sind. Bei einer Reproduzierbarkeit von 2%, wie sie den meisten absorptiometrischen Verfahren in praxi zukommt, heißt das, daß erst ein Verlust von 2,83×2%, also ca. 5,7% der vorhandenen Knochenmasse zuverlässig mit einer Konfidenz von 95% erfaßbar ist. Bei einem angenommenen Masseverlust von 3% jährlich, den wir schon als Fast-Loser-Situation definieren, heißt das, daß dieser Verlust erst nach 2 Jahren zuverlässig erfaßt werden kann. Kontrollmessungen nach beispielsweise 9 oder 12 Monaten, wie nicht selten empfohlen, sind in solchen Fällen sinnlos, weil ein Masseverlust von 3% nach dieser Zeit von der Gerätegenauigkeit her nicht erfaßt werden kann. Mit der vorhin beschriebenen hochauflösenden pQCT können Verluste in dieser Größenordnung bei einer Reproduzierbarkeit zwischen 0,2 und 0,3% an gemischten Kollektiven schon nach 4-6 Monaten zuverlässig bestimmt werden (MRD=2,83×0,2%= 0,6%, d.h. bei einem Verlust von 3% jährlich sind 0,6% Verlust, die zuverlässig erfaßbar sind, bereits nach 2-3 Monaten erreicht!).
Wertung der Osteodensitometrie
Die Methode, die alle an eine rationale Diagnose gestellten 6 Forderungen erfüllt, ist derzeit die hochauflösende periphere, quantitative Computertomographie – pQCT – mit dem Schweizer Gerät Densiscan 1000. Durch die mögliche selektive Bestimmung trabekulärer und kortikaler Knochendichten wird eine Unabhängigkeit vom Meßort erreicht und eine Aussage über den Zustand des ganzen Skelettes möglich. Die Osteoporose ist ja eine systemische Krankheit und insofern tritt ein Verlust von beispielsweise trabekulärem Knochen eben im gesamten Skelett auf. Zudem wurde in Studien eine sehr hohe Korrelation der trabekulären Knochenmasse am ultradistalen Radius mit der trabekulären Knochenmasse an Wirbelkörpern von über 90% gezeigt.
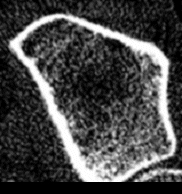
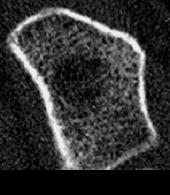
Wie wichtig dabei die Strukturbeurteilung ist, mag folgendes Beispiel verdeutlichen: bei 2 Patientinnen wurden nahezu gleiche Spongiosadichten gemessen, 191 mg/cm3 bei Patientin 1 (Abb. 5) bzw. 187 mg/cm3 bei Patientin 2 (Abb. 6) entsprechend 78% bzw. 76% der peak-bone-mass (das entspricht knapp 2,5 Standardabweichungen unterhalb der Dichtewerte junger gesunder Erwachsener = grenzwertig osteoporotische Dichtewerte nach WHO-Definition). Nun hat Patientin 1 zwar eine etwas aufgelockerte, aber weitgehend regelmäßige und homogene Trabekelstruktur, während Patientin 2 bereits massive Strukturstörungen und zahlreiche Mikrokallusbildungen (healing micro-fractures) aufweist. Verfügt Patientin 1 wahrscheinlich nur über eine vermindert angelegte peak-bone-mass, ohne daß bisher bereits ein gravierender Mineralverlust aufgetreten ist, besaß Patientin 2 ursprünglich sicher eine weit höhere Knochenmasse, wobei es aber irgendwann zu gravierenden Mineralverlusten kam. Da natürlich auch die Mikrokallusbildungen in die Bestimmung der Knochendichte eingehen, müßte die bei Patientin 2 gemessene Knochendichte sogar noch nach unten korrigiert werden. Mit herkömmlichen Meßmethoden würden notgedrungen beide Patientinnen gleich beurteilt und demnach auch gleich behandelt werden, während bei genauer Kenntnis dieser Tatsachen vorerst eigentlich nur bei Patientin 2 eine behandlungsbedürftige Osteoporose vorliegt.
abs. Spongiosadichte: 191mg/cm3, entspricht 78% peak-bone-mass aufgelockerte aber noch homogene Trabekelstrukturen weiblich, 44 Jahre
abs. Spongiosadichte: 187mg/cm3 entspricht 76% peak-bone-mass ausgeprägter Abbau bei inhomogenen Trabekelstrukturen weiblich, 53 Jahr
Absorptiometrische Verfahren können letztlich nur ein Frakturrisiko in Bezug auf statistische Referenzwerte angeben. Individuelle Beurteilungskriterien aufgrund der tatsächlichen Verhältnisse, wie sie echte Dichtewerte für trabekulären und kortikalen Knochen sowie der Zustand der knöchernen Strukturen bieten, sind nur bedingt möglich. Der Terminus „Knochendichtemessung“ ist damit strenggenommen nicht exakt und müßte eigentlich CT-Verfahren vorbehalten bleiben. Zu den Ultraschallmessungen ist zu sagen: es handelt sich nicht um Dichtemessungen und es ist weder ein Verlust von Knochenmasse damit feststellbar noch eine Unterscheidung bez. trabekulären und kortikalen Knochens zu treffen und es ist auch keine Strukturbeurteilung möglich. Bei Verlaufsmessungen auf Änderung des Mineralgehaltes zu schließen, ist sicher ebenfalls nicht zuverlässig möglich, jedenfalls noch nicht zur Zeit und noch nicht am Individuum, das es letztlich aber zu behandeln gilt.
Aktueller Stand der Prophylaxe- und Therapiemöglichkeiten
Grundsätzlich stehen uns heute folgende therapeutischen Konzepte zur Verfügung: Schmerztherapie, Ausschaltung von Risikofaktoren, physikalische und medikamentöse Therapie, wobei ich mich hier auf den aktuellen Stand der medikamentösen Therapie beschränken will, ohne die Wichtigkeit der anderen Therapieformen schmälern zu wollen. Gerade eine intensive physikalische Therapie ist bei der Osteoporose von allergrößter Bedeutung!
Bei der medikamentösen Therapie unterscheiden wir heute 3 Gruppen knochenwirksamer Substanzen. Neben den Basistherapeutika sind dies einerseits die antiresorptiven und andererseits die knochenaufbaustimulierenden Medikamente.
Zu den Basistherapeutika („golden standard“) zählen Calcium und das Vitamin D. Beide sind unabdingbar für einen gesunden Knochenstoffwechsel. Bildet das Calcium quasi den Baustein des Knochens, ist das Vitamin D für die Calciumresorption im Darm sowie dessen Transport zum Knochen hin und dem darauffolgenden Einbau in den Knochen – der Mineralisation – von überragender Bedeutung. Gerade bei der Typ-II-Osteoporose ist die Ursache häufig in einem gestörten Calcium-/Vitamin-D-Stoffwechsel zu suchen: entweder aufgrund einer mangelnden Vitamin-D-Bildung in der Haut oder eines Nachlassens der Enzymaktivitäten in Leber und vor allem der Niere, wo das inaktive Vitamin D3 in das aktive Vitamin D3-Hormon, das 1,25-Dihydroxycholecalciferol, umgewandelt wird. Das Absinken des Serumcalciumspiegels bewirkt eine erhöhte Ausschüttung von Parathormon in der Parathyroidea, welches dann wiederum zu einer verstärkten Resorption von Calcium aus dem Knochen und somit zu einem Masseverlust führt. Natürlich ist die Gabe von Vitamin D nur sinnvoll, wenn auch die Umwandlung zum aktiven D3-Hormon in Leber und Niere ungestört funktioniert. Ist dies nicht mehr der Fall, bringt auch die Gabe von Vitamin D wenig und die Alternative ist die Verabreichung eines Vitamin-D-Metaboliten, z.B. Alphacalcidol. Sowohl zur Prophylaxe wie auch zur Therapie (auch unter einer Kortison-Therapie) scheinen 1000-1200mg Calcium und 800-1000IE Vitamin D die adäquate Dosis zu sein, die ggf. auf 2000-3000IE erhöht werden muß. Die Verabreichungsform, ob z.B. als Brause- oder Kautabletten, dürfte dabei eher von untergeordneter Bedeutung sein, wobei eine Aufteilung der Calciumdosis der einmaligen Gabe überlegen sein dürfte.
Antiresorptive Medikamente
1. Östrogene
2. Calcitonin
3. Bisphosphonate
4. Vitamin-D-Metaboliten
Antiresorptiva sind in der Regel Osteoklastenhemmer, d.h. sie verhindern den gesteigerten Knochenabbau über eine Hemmung der Osteoklasten. Wenn unter Antiresorptiva teilweise auch eine leichte Erhöhung der Knochendichte beschrieben wird, so scheint dies weniger einem direkten Osteoblasteneffekt zuzuschreiben zu sein, als einfach der Tatsache, daß es durch die wirksame Hemmung der Osteoklastentätigkeit zu einem Überwiegen der normalen Osteoblastentätigkeit kommt.
Östrogene sind zweifellos die nach wie vor am meisten verwendeten Antiresorptiva und zwar sowohl prophylaktisch (postmenopausale Östrogensubstitution), als auch zur Therapie. Entgegen der früher weit verbreiteten Ansicht, Östrogene würden nur wirksam sein, wenn sie innerhalb der ersten Jahre nach Einsetzen der Menopause gegeben werden, weiß man heute, daß die Wirksamkeit selbst bei Beginn 10 oder 20 Jahre nach Einsetzen der Menopause noch vorhanden ist. Natürlich muß die Compliance berücksichtigt werden, da nicht jede Frau bereit ist, wieder Blutungen in Kauf zu nehmen. Außerdem sollte eine Östrogenpropylaxe, um wirksam zu sein, wenigstens 10 Jahre, besser aber 20 Jahre oder gar lebenslang durchgehalten werden. Neben der in vielen Studien nachgewiesenen Hemmung des knöchernen Massenverlustes (Osteoklastenhemmung) werden heute auch östrogenspezifische Rezeptoren an den Osteoblasten und damit eine direkte positive Wirkung auf den knöchernen Anbau diskutiert. Bezüglich möglicher Kontraindikationen (Thromboserisiko, Mamma-Ca) sollte generell zuvor eine gynäkologische Abklärung erfolgen. Eine positive Wirkung auf die Knochendichte und eine zuverlässige Hemmung des Verlustes von Knochenmasse wurde in zahlreichen Studien nachgewiesen.
Vielversprechend scheint in Zukunft eine neue Entwicklung, die sog. selektiven Östrogen-Rezeptor-Modulatoren (z.B. Raloxifen) zu sein, die nur auf bestimmte, „ausgewählte“ Gewebe Wirkungen zeigen. So besitzen diese zwar eine den normalen Östrogenen vergleichbare Schutzwirkung auf den Knochen und auf das Herz-Kreislauf-System, haben aber keine proliferative Wirkung mehr auf Uterus- und Brustdrüsengewebe. Gerade für Frauen mit Mamma-Carcinom oder Angst vor einem erhöhten Brustkrebsrisiko unter Östrogenen scheint sich hier eine echte Alternative aufzutun.
Calcitonin war neben den Östrogenen lange eines der am häufigsten eingesetzten Medikamente. Stand früher nur ein vom Lachs gewonnenes Calcitonin zur Verfügung, das nicht selten zu beträchtlichen Nebenwirkungen geführt hat, gibt es heute ein humanes Calcitonin mit geringeren Nebenwirkungen. Eine weitere Reduktion der Nebenwirkungen wurde in jüngster Zeit mit der Einführung eines Nasensprays erzielt. Allerdings muß hier beachtet werden, daß dabei auch eine deutlich höhere Dosierung notwendig ist. Neben den „üblichen“ Nebenwirkungen (Übelkeit, Hautrötung, Flush etc.) kann es bei längerer Anwendung zu einer Sensibilisierung und zu allergischen Reaktionen kommen. Außerdem scheint die Wirksamkeit nach 1-2 Jahren abzunehmen, so daß dann längere Therapiepausen notwendig sind. Für die antiresorptive Dauertherapie sind heute modernere Medikamente vorzuziehen.
Immer noch beliebt sind die Calcitonine wegen der ihnen zugeschriebenen analgetischen Wirkung bei den typischen Osteoporoseschmerzen, vor allem nach frischen Wirbelkörperfrakturen. Allerdings ist diese analgetische Wirkung keinesfalls bei allen Patienten vorhanden und überdies ist Calcitonin ein teures Medikament. Da eine ähnliche analgetische Wirkung häufig auch mit billigeren üblichen Analgetika erreicht werden kann, die zudem oft weniger Nebenwirkungen verursachen, sollte der Einsatz von Calcitonin kritisch geprüft werden. Wird ein Einsatz hauptsächlich wegen der analgetischen Wirkung erwogen, empfiehlt sich zunächst ein Therapieversuch. Zeigt sich innerhalb einiger Wochen keine Schmerzlinderung, ist ein Wechsel zu anderen Analgetika anzustreben.
Die Bisphosphonate, eigentlich ein Nebenprodukt aus der Waschmittelindustrie (Weichmacher) haben in nur kurzer Zeit den Osteoporose-Markt erobert. Die meisten Experten halten sie für das Medikament der Zukunft. Ist diese Medikamentengruppe für die Behandlung von Knochenmetastasen oder des Morbus Paget schon seit langer Zeit im Einsatz, liegen die Zulassungen der ersten Präparate zur Osteoporosebehandlung noch gar nicht lange zurück. Bisphosphonate zählen zu den potentesten Osteoklastenhemmern, die Studienergebnisse sind sehr überzeugend. Zugelassen sind in Deutschland mittlerweile Etidronat und Alendronat, die sich in Dosierung, Einnahmemodus (Etidronat zyklisch, Alendronat kontinuierlich) und Wirkstärke unterscheiden. Unter Bisphosphonaten kommt es zu einer deutlichen Senkung der Frakturrate, insbesondere wenn bereits osteoporotische Frakturen vorhanden sind (FIT-Studie, GPRD-Studie). Zu beachten ist, daß unter Bisphosphonaten immer eine begleitende Calcium- und Vitamin-D-Gabe erforderlich ist (1000-1200mg Calcium, 800-1000 Einheiten Vitamin D tgl.).
Bisphosphonate bilden eine Schutzschicht unter den Osteoklasten und verhindern so einen weiteren Knochenabbau, was eine Indikation zum Einsatz dieser Medikamente vor allem bei High-turnover-Osteoporosen bzw. bei Vorliegen einer Fast-Loser-Situation nahelegt. Wie aber mehrere Studien zeigten, steigt während einer Biphosphonattherapie auch die Knochendichte an. Ob dies einem direkten Einfluß der Biphosphonate auf die Osteoblasten oder einfach der Tatsache zu verdanken ist, daß aufgrund der Hemmung der Osteoklasten der ohnehin stattfindende osteoblastäre Aufbau stärker zum Tragen kommt, ist noch nicht abschließend zu beantworten. Biphosphonate können oral oder intravenös gegeben werden. Nebenwirkungen bei der oralen Einnahme betreffen überwiegend den Verdauungstrakt. Biphosphonate werden in den Knochen eingebaut, scheinen aber bei den empfohlenen Dosierungen keine Beeinträchtigung der knöchernen Strukturen zu bewirken.
Vitamin-D-Metaboliten, z.B. Alphacalcidol oder Calcitriol, entsprechen der Vorstufe des aktiven Vitamin-D-Hormons, dem 1,25-Dihydroxycholecalciferol. Mit dem 1-*-Hydroxycholecalciferol wird der vor allem bei der Vitamin-D-Resistenz häufig gestörte Umwandlungsschritt des Vitamin-D’s in der Niere, die 1*-Hydroxylierung, elegant umgangen. In der Leber wird dieses dann schnell zu Calcitriol metabolisiert. Auch diese Substanzklasse verfügt – wie u.a. auch unsere Gruppe* nachgewiesen hat – über eine gute antiresorptive Wirkung und zwar, wie es scheint, über eine direkte Suppression der Parathyroidea und eine Absenkung der Parathormonsynthese und -freisetzung. Dabei konnte in jüngster Zeit neben einer signifikanten Reduktion bzw. völligen Aufhebung des trabekulären Knochenmasseverlustes bei Fast-Loser-Patienten mit Alphacalcidol und Calcitriol von unserer Gruppe sowie von japanischen Gruppen (Tanizawa) auch eine signifikante Senkung der Rate von Schenkelhalsfrakturen gezeigt werden. Neben diesen (indirekten) antiresorptiven Eigenschaften besitzen die Vitamin-D-Metaboliten den Knochenaufbau günstig beeinflussende Eigenschaften. Zum einen scheint eine signifikante Erhöhung der Calciumabsorption zu bestehen, zum anderen aber auch die Knochenmineralisation stimuliert zu werden, und zwar einerseits über eine direkte Regulation des Knochenremodelings und andererseits über eine Erhöhung der Knochenmatrixsynthese und einer Aktivierung von Knochenwachstumsfaktoren. Damit scheint insgesamt die Qualität des Knochens günstig beeinflußt zu werden. Schließlich wird auch ein positiver Einfluß auf Muskelkraft und neuromuskuläre Koordination vermutet, was sich in einer Senkung der Sturzrate bemerkbar machen soll. Risiken bestehen bei üblicher Dosierung mit 1*g tgl. vor allem bez. einer Hypercalciämie und einer Nephrocalcinose. Unter einer Therapie mit 1-*-Calcidol sollte daher eine zusätzliche Calciumsupplementation nur mit Vorsicht erfolgen und eine zusätzliche Gabe von Vitamin-D-Präparaten vermieden werden. Außerdem sind Kontrollen der Calciumserumspiegel eine Woche nach Therapiebeginn und dann im Abstand von 3-6 Monaten angezeigt.
Knochenaufbaustimulierende Medikamente
1. Calcium und Vitamin D (Basistherapeutika, s.o.)
2. Fluoride
3. Vitamin-D-Metaboliten (s.o.)
4. Anabolika
Die Fluoride besitzen zwei Wirkungen: einmal stimulieren Fluoride direkt die Osteoblastensynthese und zum anderen werden sie in das Kristallgitter des Knochens eingebaut, was sich u.a. auch in einer Dichtezunahme bei der Osteodensitometrie zeigt. Großes Erstaunen rief eine amerikanische Studie vor einigen Jahren hervor, in der unter Fluoridmedikation eine Zunahme der Frakturrate im Vergleich zu einer Placebogruppe beobachtet wurde. Wie sich später herausstellte, war dies wohl durch eine zu hohe Dosierung der Fluoride in den USA bedingt, während dieses Phänomen in Europa (niedrigere Dosierung) nicht auftrat. Die Dosierung ist also ein entscheidender Parameter.
Nicht selten kann man unter Fluoriden den Aufbau eines minderwertigen kortikalen Knochens beobachten, so daß sich der Einsatz der Fluoride auf Situationen mit intakten kortikalen Strukturen beschränken sollte. Wir verwenden Fluoride heute nur in niedriger Dosierung und bei nur mäßig reduzierter trabekulärer Knochendichte sowie intaktem kortikalen Knochen, wenn zudem noch kein allzu fortgeschrittener Trabekelabbau vorliegt, d.h. wenn die Abstände zwischen den perforierten Knochenplättchen und -bälkchen noch nicht „unüberwindbar“ sind und die Chance einer „Neuvernetzung“ noch vorhanden ist. Somit würden sich Fluoride im Gegensatz zur früher geübten Praxis eher im Anfangsstadium denn im Alter – mit in der Regel schon fortgeschrittenerer Osteoporose – anbieten.
Anabolika können wie bei Sportlerinnen auch bei der Osteoporose manchmal kleine „Wunder“ bewirken, stellen aber sicher die letzte Maßnahme unter allen verfügbaren Medikamenten dar. Neben einem direkten stimulierenden Effekt auf den Knochenaufbau wird dabei vor allem das Befinden gebessert, so daß hier nicht selten in besonders schweren Fällen der Teufelskreis von Schmerzen, dadurch bedingter Immobilisation und damit weiterer Zunahme der osteoporotischen Beschwerden und des weiteren Masseverlustes durchbrochen werden kann.
„Maßgeschneiderte“ Therapie
Für die Wahl der richtigen oder „maßgeschneiderten“ Therapie ist in Anbetracht der Vielzahl von Medikamenten mit verschiedenen Wirkmechanismen zuerst eine ausreichende Diagnose erforderlich. Es bringt beispielsweise wenig, jemanden nur aufgrund erniedrigter Dichtewerte mit einem Antiresorptivum zu behandeln, wenn kein signifikanter Masseverlust besteht. Hier wäre eher eine knochenaufbaustimulierende Therapie angezeigt. Bei älteren Patienten mit Vitamin-D-Resistenz ist sicher ein Vitamin-D-Metabolit vorzuziehen. Bei erhöhtem Masseverlust (Fast-Loser) steht selbstverständlich die antiresorptive Therapie mit Östrogenen, Bisphosphonaten (in Verbindung mit Calcium und Vitamin D!) oder einem Vitamin-D-Metaboliten an erster Stelle. Calcium und Vitamin D sind als begleitende Basismedikation praktisch immer indiziert. Calcitonin sollte eher auf Fälle mit Osteoporoseschmerzen (z.B. nach akuten WK-Frakturen) beschränkt werden und nach einigen Wochen durch andere Antiresorptiva ersetzt werden.
Auch geeignete Kombinationen sind möglich, z.B. ein Antiresorptivum und ein Fluorid oder Östrogene mit Vitamin-D-Metaboliten oder Bisphosphonaten oder zuerst antiresorptiv mit Vitamin-D-Metaboliten oder Bisphosphonaten behandeln bis der Knochenverlust gestoppt ist, dann Wechsel auf ein mehr den Aufbau stimulierendes Mittel wie z.B. ein Fluorid. Generell sollte aber eine Osteoporose-Therapie immer langfristig geplant werden, wobei eine begleitende physikalische Therapie sowie Calcium-/Vitamin D wann immer möglich eingesetzt werden sollte! Ein häufiger Wechsel des Therapieregimes verunsichert den Patienten und verringert die Erfolgsaussichten!
Mineralwasser als Calciumquelle
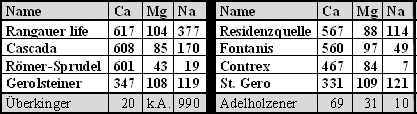
Eine unstrittige und in der Praxis immer noch viel zu wenig beachtete Calciumquelle stellen Mineralwässer dar, eine einfache, billige und gesunde Methode, die darüber hinaus noch den Vorteil hat, die Patienten zu animieren mehr zu trinken, ein Umstand, der sich gerade bei älteren Patienten günstig auswirken kann. Die Resorption des Calciums im Darm dürfte in der „natürlichen Umgebung“ der anderen ebenfalls im Mineralwasser enthaltenen Mineralien und bei dem nur geringen Phosphatgehalt des Mineralwassers im Vergleich z.B. zur Milch sogar besser und effektiver sein als bei hochkonzentrierten Calciumpräparaten. Außerdem ist das Risiko einer Nephrolithiasis dabei geringer. Hier lohnt sicher eine kurze Aufklärung der Patienten bezüglich der Vorteile dieser Form der Calciumprophylaxe. Die Tabelle zeigt einige in der Regel im Großraum München erhältliche „knochenfreundliche“ Mineralwässer (Calcium-, Magnesium- und Natriumgehalte in mg/ltr.).
Fazit: Früherkennung!
Da die manifeste Osteoporose trotz der Fortschritte in der Erkenntnis der Pathomechanismen und trotz modernster Entwicklung auf dem Medikamentensektor noch immer nicht heilbar ist, bleibt als Fazit die Früherkennung. Wie schon erwähnt schätzt man den Anteil der Fast-loser unter den postmenopausalen Frauen auf ca. 40%. Es gilt also genau diejenigen Frauen zu erfassen, um mit einer wirksamen Prophylaxe eine Osteoporose zu vermeiden. Trotz der gegenwärtigen „Biphosphonat-Euphorie“ sehe ich hier nach wie vor Östrogene als Mittel der Wahl. Aber nicht jede Frau ist ohne weiteres bereit Östrogene oder überhaupt Medikamente zur Prophylaxe zu nehmen, solange keine „hard facts“ dafür sprechen. Könnte man jedoch zuverlässig den Risikostatus feststellen, hätte man solche objektive Parameter. Unsere Gruppe* um Prof. Dambacher hat speziell dazu ein neues Screening-Modell entwickelt.
Ein neues Screening-Modell
Ausgangspunkt war die Fragestellung, ob mit nur einer einzigen Knochendichtemessung eine Abschätzung des Fast-loser-Risikos möglich ist. Wir verwendeten dazu das bildgebende Verfahren der hochauflösenden peripheren, quantitativen Computertomographie mit dem Densiscan 1000 (s.o.). Wir haben dazu bei 135 Züricher und Münchner Probandinnen zwischen 39 und 78 Jahren jeweils mindestens zweimal die trabekulären und kortikalen Knochendichten an Radius und Tibia gemessen und den Verlust an trabekulärer und kortikaler Knochenmasse auf ein Jahr bezogen verglichen. Dabei bestätigte sich einmal mehr, daß der Verlust von trabekulärem Knochen weit höher war als am kortikalem Knochen und daß der ultradistale Radius die höchsten Verlustraten aufwies. Viel erstaunlicher war aber die Tatsache, daß der Verlust an trabekulärer Knochenmasse um so höher war, je geringer die (noch) vorhandene Ausgangsmasse war. Auch der Anteil an Fast-Losern mit mehr als 3% Verlust trabekulärer Knochenmasse pro Jahr war in den Gruppen mit geringer Ausgangsdichte weit höher als in den Gruppen mit hoher Ausgangsdichte. D.h., daß das Fast-loser-Risiko und damit das Osteoporoserisiko um so höher zu sein scheint, je niedriger die aktuelle Ausgangsknochenmasse ist.
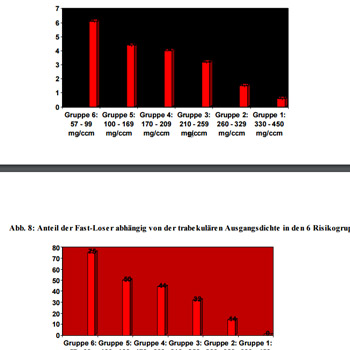
Die absoluten trabekulären Dichtewerte des Radius als Basis nehmend, haben wir damit eine Einteilung der Patientinnen in 6 Risikogruppen vorgenommen. Die Tabelle zeigt die Einteilung der 135 Probandinnen in diese 6 Gruppen, den durchschnittlichen prozentualen Verlust pro Jahr und den Anteil an Fast-Losern in den 6 Gruppen:
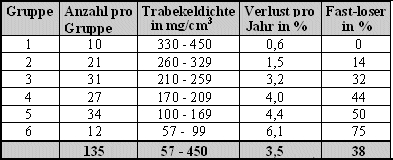
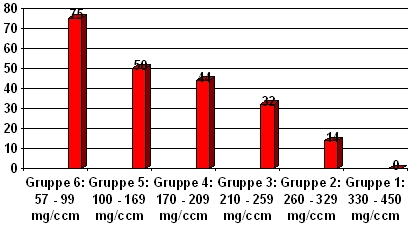
Während Gruppe 1 mit weit überdurchschnittlichen Knochendichten überhaupt keine Fast-Loser aufweist, steigt deren Anteil mit abnehmender Knochenmasse bis auf 75% in Gruppe 6 an, wo sich die Dichtewerte schon tief im Osteoporosebereich befinden. Abb. 7 und 8 zeigen diesen Zusammenhang graphisch.
Abb. 7 : Trabekulärer Masseverlust in % der Ausgangsdichte der 6 Risikogruppen:
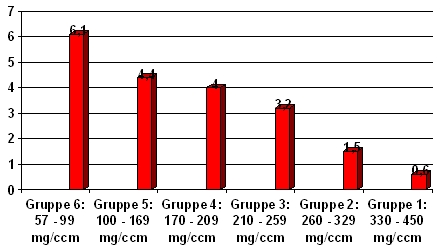
Abb. 8: Anteil der Fast-Loser abhängig von der trabekulären Ausgangsdichte in den 6 Risikogruppen:
Osteoporose-Screening für alle?
Während demnach die Gruppe 1 mit den höchsten absoluten Dichtewerten über praktisch kein Osteoporoserisiko verfügen sollte und von daher im Prinzip weder weitere Messungen noch eine Prophylaxe notwendig wären, könnten beispielsweise Patienten der Risikogruppen 2 oder 3 vor Einleitung einer möglichen Prophylaxe nach 2-3 Jahren einer nochmaligen Messung unterzogen werden, um erst dann – nach Kenntnis des genauen Ausmaßes des eventuell bestehenden Masseverlustes – die individuell angepaßte Prophylaxe einzuleiten. Bei Patienten der Gruppen 4-6 mit einem hohen Fast-Loser-Risiko hingegen könnte sinnvollerweise sofort mit einer antiresorptiven Behandlung, z.B. mit Östrogenen, Vitamin-D-Metaboliten oder Bisphosponaten, begonnen werden. Mit dieser Unterteilung in „No-risk“, Low-risk“ und „High-risk“ Gruppen mit entsprechend unterschiedlichem aber rational begründetem weiteren Vorgehen verfügen wir über eine zuverlässige Screening-Methode, mit der besonders gefährdete Fast-Loser-Patienten und Patienten mit verminderter Knochenmasse (aus genetischen oder sonstigen Gründen) frühzeitig und gezielt erfaßt und individuell gezielt behandelt werden könnten.
Wir plädieren daher für ein frühzeitiges und einmaliges Screening (als Basismessung) bei allen Frauen spätestens mit Einsetzen der Menopause sowie bei allen Personen (männlich und weiblich), die über besondere Risikofaktoren verfügen (z.B. Kortisontherapie, Hyperthyreose, Malabsorptionssyndrom, familiärer Osteoporosebelastung, frühzeitige Ovarektomie etc.), weil wir überzeugt sind, das massive Fortschreiten der Osteoporose damit wirksam eindämmen zu können. Über die Abschätzung des Osteoporoserisikos aufgrund der Ausgangsmasse hinaus wird diese Risikoabschätzung mit der zusätzlich möglichen Beurteilung der knöchernen Strukturen auf noch wesentlich sicherere Beine gestellt. Einen wichtigen und unseren Erfahrungen nach bisher noch verkannten Aspekt stellen dabei Mikrokallusbildungen nach vorangegangenen Mikrofrakturen dar. Diese sind aber nur mit einem bildgebenden Verfahren nachweisbar.
Mikrokallusbildungen! Bedeutung bisher verkannt?
Bei Betrachtung der Strukturbilder von Osteoporose-Patienten sind häufig teils ausgeprägte Mikrokallusbildungen als streifige bzw. diffuse Verdichtungen erkennbar. Gerade bei ausgeprägten Osteoporosen mit extrem niedrigen Dichtewerten sind Mikrokallusbildungen oft die überwiegenden noch erkennbaren Strukturen. Neu auftretende Mikrokallusbildungen könnten damit aber die gemessene Knochendichte bei einer Verlaufsmessung hochsignifikant erhöhen, obwohl de facto keinerlei Erhöhung der Knochenmasse stattgefunden hätte! Gerade bei der Frage der Therapiekontrolle ist in solchen Fällen die Strukturbeurteilung eigentlich unerläßlich. Natürlich bedarf es noch genauerer Studien zur Verifizierung dieser Beobachtungen. Eine Bestätigung dieses Phänomens könnte aber durchaus die Ergebnisse einiger Studien zumindest ins Wanken bringen!
abs. Spongiosadichte: 191mg/cm3, entspricht 78% peak-bone-mass aufgelockerte aber noch homogene Trabekelstrukturen weiblich, 44 Jahre
abs. Spongiosadichte: 187mg/cm3 entspricht 76% peak-bone-mass ausgeprägter Abbau bei inhomogenen Trabekelstrukturen weiblich, 53 Jahre
Die beiden Bildbeispiele zeigen zwei Patientinnen mit ausgeprägten Mikrokallusbildungen, links eher diffus, rechts eher streifig. Die gemessenen Knochendichten dürften in beiden Fällen wesentlich von den Mikrokallusbildungen (mit-) bestimmt werden, so daß eine Beurteilung solcher Patienten mit nicht bildgebenden Verfahren nur aufgrund eines Dichtewertes doch problematisch wird. Die Patientin links hat übrigens (trabekuläre) Dichtewerte, die noch im Normbereich liegen, während die bereits ausgeprägten Störungen der knöchernen Mikroarchitektur mit teilweise fast gänzlich aufgelöster Trabekelstruktur zentral und subkortikal für einen schon beträchtlichen stattgefundenen bzw. immer noch stattfindenden Knochenmineralverlust mit konsekutiv schon erhöhtem Frakturrisiko sprechen. Bei der Patientin rechts wird die (trabekuläre) Knochendichte ebenfalls zum überwiegenden Teil von den hier ausgeprägten streifigen Mikrokallusbildungen bestimmt und fällt dadurch garantiert zu hoch aus. Die kortikalen Dichtewerte liegen im übrigen bei beiden Patientinnen im Normbereich, auch sind kortikal bisher kaum Strukturstörungen zu erkennen. Man sieht an diesen beiden Beispielen, wie wichtig die Knochenstrukturdarstellung für die korrekte Beurteilung ist. Die Patientin links würde mit herkömmlichen Knochendichtemessungen als unauffällig durchgehen, bei der Patientin rechts würde der Knochen noch deutlich besser eingeschätzt werden, als es tatsächlich der Fall ist.
Sowohl manche gemessene Knochendichte als auch die oft mit Stolz beobachteten deutlichen bis manchmal an Wunder grenzenden Dichtezunahmen unter diversen Therapien könnten sich teilweise als eine Fata Morgana herausstellen, wenn die Dichtezunahme möglicherweise gar nicht auf den stolz verkündeten Therapieeffekt, sondern schlichtweg nur auf neu aufgetretene Mikrokallusbildungen zurückzuführen wäre.
Erst die Strukturdarstellung gibt Aufschluß!
Wir plädieren daher für eine weitere Verbreitung der modernen Verfahren, die neben einer exakten (volumetrischen) Knochendichtemessung auch die Strukturanalyse als neue, zusätzliche Dimension und damit eine frühzeitigere und sicherere Diagnose bzw. Einschätzung des individuellen Frakturrisikos ermöglichen. Darüber hinaus ist aufgrund der signifikant besseren Reproduzierbarkeit auch eine erheblich frühere Differenzierung zwischen Fast- und Slow-losern möglich, was eine wichtige Entscheidungshilfe bezüglich einer mehr antiresorptiv oder mehr den Knochenaufbau stimulierenden Therapie darstellt.
Kostensenkung durch Screening?
Last not least sei noch angemerkt, daß wir in einer groben Kostenanalyse aufzeigen konnten, daß die Kosten für ein allgemeines Screening pro 10.000 Frauen inklusive aller sich daraus ergebenden Kosten für Prophylaxe und Therapie sich allein schon aus den Einsparungen bei den Behandlungs- und Folgekosten der ansonsten statistisch zu erwartenden Schenkelhalsbrüche tragen würden. Dabei wurden die Kosten für das einmalige Screening mit DM 150,- und eine Verminderung der ohne Screening statistisch auftretenden Schenkelhalsfrakturen um nur 50% (was uns eher wenig erscheint) angenommen.
In den Kosten für Behandlung und Rehabilitation der Schenkelhalsfrakturen sind – soweit erfaßbar – auch Kosten für Nachbehandlung, Versorgung in Pflege- und Altenheimen, Verdienstausfall etc. enthalten. Nicht enthalten sind in dieser Kalkulation allerdings die Kosten aller übrigen osteoporotischer Frakturen, insbesondere Radiusfrakturen und Wirbelkörperfrakturen, so daß die tatsächlich möglichen Einsparungen durch ein Screening noch weitaus höher liegen sollten. Nicht eingerechnet sind auch nicht in Geld meßbare Faktoren wie menschliches Leid, Verlust an Lebensqualität etc., also die Faktoren, denen zu begegnen eigentlich immer noch – trotz „Gesundheitsreformen“ und anderer Einschränkungen unserer Arbeit – das Hauptaugenmerk unserer ärztlichen Tätigkeit gelten sollte.
*ZMORG – Zürich-München-Osteoporosis-Research-Group
Labor für Calciumstoffwechsel, Orthopädische Universitätsklinik Balgrist Zürich
Prof. M.A. Dambacher
Forchstraße 340
CH – 8008 Zürich
Osteoporose-Zentrum Zürich
Dr. med. Maurus Neff
Limmatplatz 1
CH – 8008 Zürich
Osteoporose-Diagnostik- und Therapiezentrum München
Dr. med. Helmut Radspieler, Dr. med. Hans Donhauser, Prof. M.A. Dambacher
Karlsplatz 4
80335 München
Tel. 089/59 25 24, Fax: 089/550 25 13

Liebe Patientinnen, liebe Patienten,
Ich bin Professor Dr. Dietmar Daichendt, Ihr Experte auf dem Gebiet der Osteoporose und Knochengesundheit!
In meiner langjährigen Praxis habe ich mich darauf spezialisiert, Menschen mit Osteoporose die bestmögliche Behandlung und Betreuung zu bieten.
Mit meiner Privatpraxisklinik, die auf Ihre Bedürfnisse zugeschnitten ist, möchten wir sicherstellen, dass Sie sich bei uns wohl und gut aufgehoben fühlen. Wir legen Wert auf Barrierefreiheit, Komfort und höchsten Standard in der medizinischen Versorgung.
Ich stehe Ihnen gerne zur Verfügung, um Ihnen bei Fragen rund um Osteoporose und Knochengesundheit zu helfen. Vertrauen Sie auf meine Expertise und meine langjährige Erfahrung in der Behandlung dieser Erkrankung.
Ihr
Prof. Dr. med. Dietmar Daichendt