Diagnostik und Therapie der Osteoporose
erschienen in: CF Journal für die ärztliche Praxis 5-2001
Einführung:
Wir erleben derzeit einen grundlegenden Wandel der Bevölkerungsstruktur mit einem enormen Anstieg der Zahl älterer Menschen wie noch niemals zuvor in unserer Geschichte. Damit ändert sich auch das Krankheitsspektrum.
Die Osteoporose zählt dabei sicher zu den großen Herausforderungen der Zukunft und mit ca. 8-10 Millionen Betroffenen allein in Deutschland bereits jetzt zu den wichtigsten Volkskrankheiten (WHO). Allerdings ist nicht so ganz klar, wie diese Zahlen zustande kommen.
Werden hier nur alle Patienten mit manifesten Frakturen oder bereits alle diejenigen, bei denen eine Osteodensitometrie entsprechend niedrige Werte aufweist, hinzugezählt? Das ist aber entscheidend, denn letztlich geht es ja darum, betroffene Patienten bzw. Risikopatienten möglichst zuverlässig nicht nur frühzeitig zu erfassen, sondern einer adäquaten Therapie zuzuführen.
An neuen Diagnose- und Therapiemöglichkeiten gebricht es mittlerweile zwar nicht mehr, doch führen nicht zuletzt gerade die Vielzahl der mittlerweile existierenden Messmethoden und der in der Praxis oft uneinheitliche Gebrauch der Beurteilungskriterien häufig zu differierenden bzw. sogar widersprüchlichen Einschätzungen. Einer exakten Diagnosestellung kommt daher grundlegende Bedeutung zu.
Osteoporose Definitionen
Ein Problem dabei liegt bereits in der unterschiedlichen Verwendung des Begriffes Osteoporose begründet: so wird das mittels einer osteodensitometrischen Messung festgestellte erhöhte statistisches Frakturrisiko mittlerweile ebenso als Osteoporose bezeichnet wie die manifeste Krankheit mit osteoporotischen Frakturen, gemäß der heute in der Praxis üblicherweise verwendeten pragmatischen Definition der WHO über das T-Score-System.
Unterhalb eines T-Scores von – 2,5 SD liegt danach eine Osteoporose vor, zwischen – 1 SD und – 2,5 SD eine Osteopenie. Das klingt einfach und plausibel. Aber man muss sich immer wieder vor Augen halten, dass die Osteodensitometrie nur einen Dichtewert bzw. ein statistisches Frakturrisiko bestimmt, unabhängig von der eigentlichen Klinik.
Außerdem gilt die WHO-Definition nur für absorptiometrische Messungen (DXA), wird aber in der Praxis von vielen Untersuchern für alle Messverfahren verwendet. Ein T-Score von – 2,8 SD gemessen mit einer Ultraschallmethode beispielsweise am Finger ist aber nicht gleichbedeutend mit einem T-Score von – 2,8 SD, gemessen mittels DXA am Schenkelhals.
Osteodensitometrie ist nicht gleich Osteodensitometrie
Dies resultiert aus der Tatsache, dass die verschiedenen osteodensitometrischen Methoden unterschiedliche Parameter messen. Genaugenommen messen nur computertomographische Methoden (QCT, pQCT) eine echte (physikalische) Dichte in mg/cm3. Absorptiometrische Methoden (DXA) messen eine sog. Flächendichte in g/cm2, d.h. hier wird die Absorption eines Röntgenstrahls über eine bestimmte Fläche auf dem Weg durch den gesamten Körper gemessen.
Bei schlanken und vor allem großen Personen weisen z.B. die Wirbelkörper aber auch der Femurhals nicht selten einen geringeren Querschnitt bzw. eine dünnere Kortikalis auf. Da die Kortikalis aber eine 6-8-fach höhere Volumendichte aufweist als die Spongiosa, kann die integral gemessene Gesamtknochendichte dadurch überproportional geringer ausfallen. Außerdem verkürzt sich die Wegstrecke des Röngenstrahls durch das Knochengewebe mit der Folge einer geringeren Strahlenabsorption, was ebenfalls zu niedrigeren Werten des gemessenen Mineralgehalts in g/cm2 führen, aber trotzdem mit nahezu normalen volumetrischen Dichtewerten verbunden sein kann.
Andererseits bedingen z.B. Spondylophytenbildungen oder Aortenverkalkungen falsch hohe Werte aufgrund einer erhöhten Strahlenabsorption. Mit Ultraschall wird keine Dichte gemessen, sondern die Geschwindigkeit des Ultraschalls (SOS = speed of sound) auf dem Weg durch die untersuchte Körperregion in m/s bzw. die Schallausbreitung (BUA = broadband ultrasound attenuation) in db/mhz. Insofern ist die Bezeichnung Ultraschall-Osteodensitometrie irreführend, da ja de facto keine Knochendichte gemessen wird. Allerdings korrelieren sowohl die SOS als auch die BUA bzw. deren mathematische Verknüpfung – die sog. Steifigkeit – statistisch gut mit dem Frakturrisiko. Mit Ultraschall wird also ein statistisches Frakturrisiko quantifiziert, eine Diagnosestellung Osteoporose entsprechend der WHO-Definition ist damit nicht möglich!
T-Score
Die WHO-Definition über den T-Score orientiert sich an der mittleren peak-bone-mass jüngerer, gesunder Erwachsener und bewertet die Abweichung der gemessenen Knochendichte von diesem Mittelwert. Die ursprüngliche individuelle peak-bone-mass ist in der Regel nicht bekannt, die Bewertung der Messergebnisse daher immer eine statistische. Daher können wir im Fall eines erniedrigten Knochenmineralgehaltes im Einzelfall auch nicht beurteilen, ob ein erniedrigter Wert durch eine bereits unterdurchschnittlich entwickelte peak-bone-mass oder einen größeren Knochenmasseverlust bei einer ursprünglich normalen peak-bone-mass bedingt ist. Dies ist aber wesentlich für eine Therapieentscheidung, da nur ein signifikanter Knochenabbau auch entsprechende Störungen der knöchernen Mikroarchitektur bewirken sollte.
Frakturrisiko
Die ursprüngliche Konsensusdefinition definiert die Osteoporose als systemische Skeletterkrankung mit verminderter Knochenmasse aufgrund eines vorangegangenen Knochenmasseverlustes und dadurch bedingten Zerstörungen der knöchernen Mikroarchitektur. Das Frakturrisiko ist also nicht nur abhängig von der (noch) vorhandenen Knochenmasse, sondern auch von der strukturellen Integrität bzw. vom Ausmaß der Strukturdefekte; außerdem spielt die Dynamik des Knochenverlustes eine Rolle. Somit sollte ein Patient mit einer niedrigen Knochendichte aufgrund einer ursprünglich bereits niedriger entwickelten peak-bone-mass aber bisher fehlenden Mineralverlusten und daher noch überwiegend homogener Knochenstruktur in der Tat über ein geringeres Frakturrisiko verfügen als ein Patient mit der gleichen (erniedrigten) Knochendichte, jedoch einer ursprünglich normalen peak-bone-mass und zum Untersuchungszeitpunkt schon gravierenden Strukturdefekten als Folge des vorangegangenen Knochenabbaus.
Knochendichte und Knochenstruktur
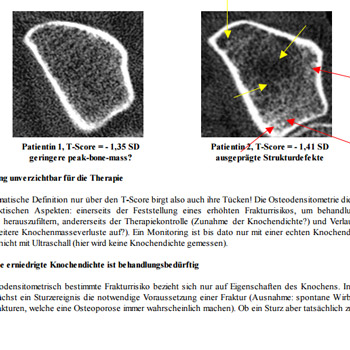
Die Knochenstruktur in vivo ist bis dato aber nur mit der Methode der hochauflösenden, bildgebenden peripheren Computertomographie erfassbar, die nur in wenigen Zentren zur Verfügung steht. Unsere Gruppe um Prof. M.A. Dambacher arbeitet seit Jahren mit dieser Methode (Densiscan 1000, Scanco Medical AG, Zürich). Die Vorteile sind neben der selektiven Messung der trabekulären und kortikalen Knochendichten vor allem die bildliche Darstellung der knöchernen Mikroarchitektur in hoher Auflösung (0,2mm). Ein Beispiel soll dies erläutern:
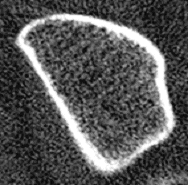
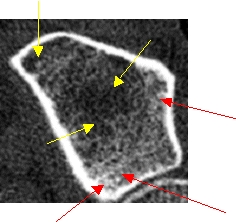
Bei 2 Patientinnen wurden nahezu identische trabekuläre Knochendichten am Radius gemessen, 191mg/cm3 bei Patientin 1 (T-Score: – 1,35 SD) bzw. 187mg/cm3 bei Patientin 2 (T-Score: – 1,41 SD). Zeigt Patientin 1 eine aufgelockerte, aber noch überwiegend homogene Trabekelstruktur, weist Patientin 2 schon massive Strukturdefekte (Demineralisierungen, gelbe Pfeile) und zahlreiche Mikrokallusbildungen (Verdichtungen, rote Pfeile) auf.
Bei Patienten 1 ist in erster Linie eine bereits vermindert angelegte peak-bone-mass anzunehmen, ohne daß bereits gravierende Masseverluste aufgetreten zu sein scheinen, Patientin 2 besaß ursprünglich sicher eine weit höhere Knochenmasse, denn hier sind schon ausgeprägte Abbauprozesse zu erkennen. Eine Beurteilung nur aufgrund des Dichtewertes wäre hier problematisch, weil entweder Patientin 2 gar nicht oder Patientin 1 unnötig z.B. mit einem Bisphosphonat behandelt würde!
 |
 |
| Patientin 1, T-Score=- 1,35 SD geringere peak-bone-mass? |
Patientin 2, T-Score=- 1,41 SD ausgeprägte Strukturdefekte |
Monitoring unverzichtbar für die Therapie
Die pragmatische Definition nur über den T-Score birgt also auch ihre Tücken! Die Osteodensitometrie dient ja vor allem zwei praktischen Aspekten: einerseits der Feststellung eines erhöhten Frakturrisikos, um behandlungsbedürftige Patienten herauszufiltern, andererseits der Therapiekontrolle (Zunahme der Knochendichte?) und Verlaufsbeurteilung (treten weitere Knochenmasseverluste auf?). Ein Monitoring ist bis dato nur mit einer echten Knochendichtemessung möglich, nicht mit Ultraschall (hier wird keine Knochendichte gemessen).
Nicht jede erniedrigte Knochendichte ist behandlungsbedürftig
Das osteodensitometrisch bestimmte Frakturrisiko bezieht sich nur auf Eigenschaften des Knochens. In der Regel ist aber zunächst ein Sturzereignis die notwendige Voraussetzung einer Fraktur (Ausnahme: spontane Wirbelkörper- oder Rippenfrakturen, welche eine Osteoporose immer wahrscheinlich machen).
Ob ein Sturz aber tatsächlich zu einer Fraktur führt, hängt zuallererst auch vom Sturzereignis ab. Aufprallenergie, wie läuft der Sturz ab, Konstitution, Beweglichkeit etc. sind alles wichtige Faktoren, die unabhängig vom Zustand des Knochens mit entscheiden, ob es zu einer Fraktur kommt.
Nicht alle dieser Faktoren sind beeinflußbar. Wenn z.B. ein großer, schlanker Patient über eine mittels DXA an der LWS gemessene niedrige integrale Knochendichte aufgrund einer unterdurchschnittlich entwickelten peak-bone-mass verfügt (die volumetrische Knochendichte kann dabei durchaus normal sein), werden wir dessen erhöhtes Frakturrisiko kaum mit einem Bisphosphonat reduzieren können.
Hier liegt ja nicht unbedingt eine Störung der Knochenarchitektur vor, sondern hier dürfte die erniedrigte integrale Knochendichte und das damit begründete erhöhte Frakturrisiko vor allem konstitutionell bedingt sein (ein langer, dünner Ast bricht eben leichter als ein kurzer dicker).
Entscheidend ist immer der Gesamtaspekt
Egal, welche Messmethode verwendet wird, ist es wichtig, sich immer wieder vor Augen zu führen, was die Methode tatsächlich misst und wo die möglichen Fehlerquellen liegen. Generell kann die Osteodensitometrie immer nur ein – wenn auch wichtiger – Baustein in der Gesamtdiagnostik sein. Unentbehrlich sind vor allem Anamnese, Frakturstatus, das Vorliegen von Risikofaktoren, Klinik, Konstitution und körperliche Untersuchung – auch einfacher Parameter wie z.B. die Körpergröße. Die Osteodensitometrie dient dann zur Abrundung des Gesamtbildes, zur Abschätzung des Schweregrades einer evtl. vorliegenden Osteopenie oder Osteoporose und als Entscheidungshilfe, ob bzw. wenn ja, welche Therapie eingeleitet werden soll.
Therapiemöglichkeiten
Grundsätzlich stehen uns zur Therapie drei Säulen zur Verfügung: Ernährung, Bewegung und Medikamente.
Basistherapie ist immer Calcium und Vitamin D3
Die Ernährungsberatung sollte besonders eine ausreichende Calcium- und Vitamin D3-Zufuhr berücksichtigen. Calcium ist hauptsächlich in Milchprodukten aber auch in wenigen, ausgewählten Mineralwässern in größeren Mengen enthalten.
Vor allem der Gebrauch calciumreicher Mineralwässer (Calciumgehalt wenigstens 300-400mg/l) stellt eine gesunde und natürliche Möglichkeit der Substitution dar, gerade auch wenn z.B. auf den Cholesterinspiegel geachtet werden muss oder wenn Patienten Milchprodukten eher ablehnend gegenüber stehen.
Die übrigen Lebensmittel mit einem hohen Gehalt an Calcium wie Mohn, Sesam, Nüsse, frische Kräuter sind nur als Ergänzung und nicht zur Dauerversorgung geeignet. Vitamin D3 ist vorwiegend in frischem Seefisch enthalten, hier sollte deshalb eher auf eine Substitution in Form von Tabletten zurückgegriffen werden. Calcium und Vitamin D3 sind notwendiger Bestandteil jeder Osteoporosetherapie.
Dosierung: Prävention (Osteopenie): Calcium 500mg/Vitamin D3 400-500 I.E. Therapie (Osteoporose): Calcium 1000-1200mg/Vitamin D3 800-1000 I.E.
Bewegung
Dass körperliche Aktivitäten über die Muskelwirkung auf den Knochen (Druckbelastung gegen die Schwerkraft) die Osteocyten anregen und damit das Knochenremodeling positiv beeinflussen, ist unbestritten. Regelmäßige körperliche Aktivitäten sollten deshalb ebenfalls immer (so weit als möglich) ein fester Bestandteil der Therapie und möglichst auch der Prophylaxe sein.
Sehr zu empfehlen sind hier z.B. medizinische Kräftigungstherapie bzw. Übungen im Fitness-Studio, aber auch Walking, Aerobic, Thai Chi, Osteoporosegymnastik. Selbst regelmäßiges forciertes Gehen (tgl. wenigstens 30 Minuten) kann dem Knochen etwas nützen. Leider existieren viel zu wenige ambulante Einrichtungen, speziell für ältere Patienten mit manifester Osteoporose, so dass dieser Teil der Therapie sich in der Praxis schon von der Logistik her oft sehr schwierig bis manchmal unmöglich gestaltet!
Medikamentöse Therapie
Wenn wir uns einmal aufgrund einer sorgfältigen Diagnose auf eine behandlungsbedürftige Osteoporose festgelegt haben, sollten wir auch bei der Wahl der Therapie konsequent bleiben und auf ein Medikament zurückgreifen, für das die Wirksamkeit zuverlässig evaluiert ist.
Die medikamentöse Therapie verfolgt dabei in der Hauptsache zwei Ziele: die Vermeidung weiterer Knochenmasseverluste über eine Osteoklastenhemmung und die Vermeidung weiterer Frakturen bzw. eine prägnante Reduktion des weiteren Frakturrisikos! Ein Anstieg der Knochendichte ist zwar wünschenswert und zeigt auch ein Ansprechen auf die Therapie bzw. eine gute Compliance (Monitoring), ist aber nicht mehr das Primärziel.
Evidence based medicine vs. Erfahrung
Zugelassen zur Osteoporosetherapie sind eine ganze Reihe von Medikamenten: Calcium, Vitamin D3, Östrogene, Fluor, Calcitonin, Vitamin-D-Metaboliten, Bisphosphonate, Raloxifen, Anabolika. Eine Knochendichtezunahme ist zwar für alle genannten Medikamente nachgewiesen, nur für einige ist aber die erwünschte Wirkungen im Sinne der oben aufgeführten primären Therapieziele (Frakturrisikoreduktion) in placebokontrollierten Doppelblindstudien an ausreichend großen Kollektiven überzeugend nachgewiesen: Calcium/Vitamin D3, Raloxifen 60mg, Risedronat 5mg tgl. und Alendronat 10mg tgl. bzw. 70mg 1x wöchentlich.
Für die Kombination Calcium 1200mg/Vitamin D3 800 I.E. konnte eine Reduktion der Schenkelhalsfrakturen um 43%, für Raloxifen eine Reduktion der Wirbelkörperfrakturen um ca. 50% nachgewiesen werden. Nur für Alendronat und Risedronat ist sowohl eine Reduktion der Schenkelhalsfrakturen als auch der vertebralen Frakturen bewiesen. Für die übrigen Medikamente existieren widersprüchliche Ergebnisse bzw. unzureichende Daten. Die Tatsache, dass eine fraktursenkende Wirkung z.B. für Östrogene nicht nachgewiesen ist, muss allerdings nicht bedeuten, dass eine solche Wirkung nicht existiert. Trotzdem sollten Medikamente wie Östrogene, Fluor, Calcitonin etc. aufgrund der aktuellen Datenlage heute auf die Prävention bzw. auf Patienten mit Osteopenie beschränkt bleiben.
Die Hormonersatztherapie eignet sich nach wie vor besonders zur Prävention postmenopausaler Frauen ohne erhöhtes Brustkrebsrisiko in der Anamnese, um einen postmenopausalen Knochenmasseverlust zu vermeiden. Eventuell kann auch in speziellen Fällen oder auch bei Männern mit einer Osteopenie ein niedrig dosiertes Fluorideingesetzt werden, wenn ein high-turnover bzw. eine Fast-Loser-Situation ausgeschlossen ist. Bei Männern mit Hypogonadismus ist zur kausalen Therapie Testosteron zunächst das Mittel der Wahl, zumindest solange nur eine Osteopenie besteht.
Bei einer manifesten Osteoporose mit bereits vorhandenen Frakturen bzw. bei einer osteodensitometrisch gesicherten (präklinischen) Osteoporose mit entsprechendem Risikoprofil sollten heute grundsätzlich die neuen Präparate mit gesicherten Wirkprofil wie Alendronat, Risedronat oder Raloxifen, jeweils in Kombination mit Calcium und Vitamin D3, eingesetzt werden.
Raloxifen ist hier vor allem bei jüngeren (aber schon postmenopausalen) Patientinnen das Mittel der Wahl, wenn der Knochenabbau noch weitgehend auf den trabekulären Knochen beschränkt ist, also bei der sog. Typ-I-Osteoporose, vor allem wenn z.B. eine Brustkrebsanamnese oder ein erhöhtes Brustkrebsrisiko bzw. zusätzlich eine Hypercholesterinämie besteht.
Der Wirkmechanismus auf den Knochen ähnelt dem der Östrogene, bei jedoch nachgewiesener Senkung des vertebralen Frakturrisikos und positiven Nebeneffekten wie der Reduktion des Brustkrebsrisikos und des Cholesterins. Allerdings sind klimakterische Beschwerden mit Raloxifen nicht behandelbar. Sind trabekulärer und kortikaler Knochen gleichermaßen von der Osteoporose betroffen (Typ-II-Osteoporose, Nachweis mittels QCToder DXA am Schenkelhals) sollte einem Aminobisphosphonat der Vorzug gegeben werden, wobei Risedronat und Alendronat hier so ziemlich gleichwertig sein dürften. Bei Verträglichkeitsproblemen ist möglicherweise Risedronat geeigneter, multimorbide Patienten mit zahlreichen Medikamenten profitieren im Sinne einer Medikamentenreduktion vielleicht eher von der wöchentlichen Einmaldosis Alendronat 70mg.
Letzteres scheint bezüglich der Verträglichkeit der täglichen Gabe (10mg) überlegen zu sein. Die vierteljährlichen Infusionen von Bisphosphonaten (Pamidronat, Ibandronat) sind speziellen Fällen vorbehalten (bettlägerige Patienten, multimorbide Patienten, mangelnde Compliance etc.) oder wenn ein besonders schneller Wirkeintritt (auch bezüglich einer analgetischen Wirkung der Bisphosphonate) notwendig erscheint. Da die Studien mit Etidronat zum Teil widersprüchliche Ergebnisse bezüglich der Frakturreduktion aufweisen, sollte bei einer Indikation für ein Bisphosphonat heute immer ein Aminobisphosphonat bevorzugt werden.
Calcitonin kommt im Sinne einer evidence based medicine nur in Form der nasalen Anwendung in Frage. Da die Wirkung bezüglich der Fraktursenkung aber den Aminobisphosphonaten und Raloxifen unterlegen ist sowie auch wegen der hohen Kosten, ist dieses zur Dauertherapie der Osteoporose sicher nur in Ausnahmefällen geeignet. Wir verwenden Calcitonin in der Regel nur wegen der analgetischen Wirkung nach frischen Wirbelkörperfrakturen. Die Indikation für Vitamin-D-Metaboliten dürfte vor allem die kortikoidinduzierte Osteoporose sein, in schweren Fällen ist aber auch hier wohl eher Aminobisphosphonate vorzuziehen.
Zusammenfassung
Die Osteodensitometrie ist sowohl zur Diagnostik als auch zur Verlaufs- und Therapiekontrolle ein unverzichtbarer Bestandteil im Umgang mit der Krankheit Osteoporose. Mit den mittlerweile zahlreichen Ultraschallmethoden stehen uns billige und einfach durchzuführende Verfahren zur Verfügung, die vor allem ein flächendeckendes Screening ermöglichen und überdies die Patienten keiner Strahlenbelastung aussetzen, obwohl die Strahlenbelastung mit Ausnahme der quantitativen Computertomographie an der Wirbelsäule fast vernachlässigbar ist. Allerdings wissen wir bis dato nicht, welche Knochenqualität mit Ultraschall tatsächlich erfasst wird (sowohl die Schallgeschwindigkeit als auch die Schallausbreitung sind abhängig u.a. von Knochendichte, der Knochenstruktur, umgebenden Weichteilmantel etc.); Ultraschallmethoden sind außerdem bisher nicht zum Monitoring geeignet.
Die schon länger etablierten Knochendichtemessungen mittels DXA/DPA und QCT/pQCT bieten den Vorteil, dass hier eine bekannte Knochenqualität, nämlich die Knochenmasse gemessen wird, was unserer Vorstellung von den tatsächlichen Geschehnissen leichter zugänglich ist, als ein doch eher abstraktes statistisches Frakturrisiko. Nur mit diesen Methoden ist derzeit ein Monitoring möglich, was für die Beurteilung von Therapie, Verlauf und Compliance wichtig ist. Allerdings sind die verschiedenen osteodensitometrischen Methoden untereinander nicht vergleichbar, ein Monitoring ist daher nur am gleichen Gerät und strenggenommen auch nur durch denselben Untersucher zulässig.
Bezüglich des Messortes scheinen periphere Messorte ebenso geeignet zu sein wie die Wirbelsäule, da auch hier das Frakturrisiko zuverlässig vorhersagbar ist. Jeder Messort hat seine Vor- und Nachteile; entscheidend für die Bewertung sind u.a. spezifische Eigenschaften wie Verhältnis Spongiosa/Kortikalis, gewichtsbelasteter Knochen vs. nicht gewichtstragender Knochen. Zwar bietet die Wirbelsäule als Messort den Vorteil, die Wirbelkörper direkt zu erfassen, dafür sind Fehlerquellen (Spondylophyten, Weichteilverkalkungen etc.) häufiger. Aufgrund des höheren Kortikalisanteil eignet sich der Schenkelhals eher für ältere Patienten, da die Kortikalis eine langsamere Dynamik als die Spongiosa aufweist und der kortikale Mineralverlust in der Regel erst später auftritt. Computertomographische Messungen bieten vor allem den Vorteil einer selektiven Messung volumetrischer Dichtewerte von Spongiosa und Kortikalis, die hochauflösende pQCT darüber hinaus als einzige Methode den Vorteil einer Strukturbeurteilung.
Generell ist die Osteodensitometrie jedoch immer nur als Baustein in Verbindung mit Anamnese, Risikofaktoren, Klinik, Frakturstatus etc. zu verwenden und keinesfalls als alleinige diagnostische Methode geeignet. Je nach Methode wird mit der Osteodensitometrie entweder eine Knochendichte und/oder ein Frakturrisiko bestimmt – nicht mehr aber auch nicht weniger. Außerdem sollte bei jeder Messung berücksichtigt werden, welche Qualität des Knochens damit erfasst wird, um Fehlinterpretationen zu vermeiden. Dies sollte bei jeder Untersuchung beachtet werden.
Wenn wir uns einmal auf die Diagnose Osteoporose festgelegt haben, sollte auch die notwendige Therapie rasch und konsequent durchgeführt werden. Mit den Aminobisphosphonaten und Raloxifen stehen uns heute sehr potente Präparate mit einem gesicherten Wirkungsspektrum zur Verfügung, so dass wir trotz andauernder Kostendiskussion diesen den Vorzug geben sollten. Ob wir dabei Alendronat in der wöchentlichen oder täglichen Verabreichung, Risedronat oder Raloxifen den Vorzug geben, hängt von den individuellen Gegebenheiten ab. Calcium und Vitamin D3 sind dabei immer unerläßlicher Bestandteil der Therapie! Die Patienten sollten es uns in der Regel danken und mit der Vermeidung weiterer Wirbelkörper- und Schenkelhalsfrakturen können wir langfristig die Behandlungskosten sogar eher verringern.

Liebe Patientinnen, liebe Patienten,
Ich bin Professor Dr. Dietmar Daichendt, Ihr Experte auf dem Gebiet der Osteoporose und Knochengesundheit!
In meiner langjährigen Praxis habe ich mich darauf spezialisiert, Menschen mit Osteoporose die bestmögliche Behandlung und Betreuung zu bieten.
Mit meiner Privatpraxisklinik, die auf Ihre Bedürfnisse zugeschnitten ist, möchten wir sicherstellen, dass Sie sich bei uns wohl und gut aufgehoben fühlen. Wir legen Wert auf Barrierefreiheit, Komfort und höchsten Standard in der medizinischen Versorgung.
Ich stehe Ihnen gerne zur Verfügung, um Ihnen bei Fragen rund um Osteoporose und Knochengesundheit zu helfen. Vertrauen Sie auf meine Expertise und meine langjährige Erfahrung in der Behandlung dieser Erkrankung.
Ihr
Prof. Dr. med. Dietmar Daichendt